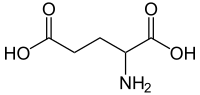
Glutaminska kiselina
| |

| |
| Nazivi | |
|---|---|
| IUPAC naziv
Glutaminska kiselina
| |
| Drugi nazivi
2-Aminopentandioksična kiselina
| |
| Identifikacija | |
3D model (Jmol)
|
|
| Abrevijacija | Glu, E |
| ChemSpider | |
| ECHA InfoCard | 100.009.567 |
| E-brojevi | E620 (pojačivač ukusa) |
| MeSH | Glutamic+acid |
| |
| Svojstva | |
| C5H9NO4 | |
| Molarna masa | 147,13 g·mol−1 |
| Agregatno stanje | beo kristalni prah |
| Gustina | 1,4601 (20°C) |
| Tačka topljenja | 199°C dekomp. |
| rastvoran | |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Glutaminska kiselina (Glu ili E) je jedna od 20 proteinskih aminokiselina.[3] Njeni kodoni su GAA i GAG. To je ne-esencijalna aminokiselina. Karboksilatni anjoni i soli glutaminske kiseline su poznati kao glutamati.
Hemija
[уреди | уреди извор]Bočni lanac, karboksilno kiselinska funkcionalna grupa, ima pKa od 4.1, i ona je u negativno naelektrisanom deprotonisanom karboksilatnom obliku na fiziološkom pH.[3]
Istorija
[уреди | уреди извор]Mada su glutaminska kiselina i druge aminokiseline prirodno prisutne u mnogim vrstama hrane, njihovi doprinosi ukusu su naučno identifikovani tek u ranom dvadesetom veku. Supstancu je otkrio i identifikovao 1866. godine Nemački hemičar Karl Heinrich Leopold Ritthausen. 1907. godine Japanski istraživač Kikunae Ikeda sa Tokijskog Imperijalnog Univerziteta je identifikovao smeđe kristale zaostale nakon evaporacije veće količine kombu supe kao glutaminsku kiselinu. Ti kristali, su imali ukus, koji je podsećao nepotpuno izraženom ali neospornom ukusu prisutnom u mnogim drugim vrstama hrane, i pogotovu u morskoj travi. Profesor Ikeda je nazvao taj ukus mesa, i druge visokoproteinske hrane, umami. On je nakon toga patentirao metod za masovnu-proizvodnju kristalne soli glutaminske kiseline, mono-natrijum glutamata.[4][5]
Biosinteza
[уреди | уреди извор]| Reaktanti | Proizvodi | Enzimi |
|---|---|---|
| Glutamin + H2O | → Glu + NH3 | GLS, GLS2 |
| NAcGlu + H2O | → Glu + Acetat | (nepoznato) |
| α-ketoglutarate + NADPH + NH4+ | → Glu + NADP+ + H2O | GLUD1, GLUD2 |
| α-ketoglutarat + α-amino kiselina | → Glu + α-okso kiselina | transaminaza |
| 1-pirolin-5-karboksilat + NAD+ + H2O | → Glu + NADH | ALDH4A1 |
| N-formimino-L-glutamat + FH4 | → Glu + 5-formimino-FH4 | FTCD |
Funkcija i upotreba
[уреди | уреди извор]Metabolizam
[уреди | уреди извор]Glutamat ključni molekul u ćelijskom metabolizmu. Kod ljudi, dijetarni proteini se razlažu u aminokiseline, koje služe kao metaboličko gorivo za druge funkcionalne procese u telu. Ključni proces u degradaciji aminokiselina je transaminacija, u kome se amino grupa jedne amino kiseline prenosi na α-ketokiselinu, što je tipično katalizovano transaminazama. Ta reakcija se može generalisati kao:
- R1-amino kiselina + R2-α-ketokiselina ⇌ R1-α-ketokiselina + R2-aminokiselina
Veoma rasprostranjena α-ketokiselina je α-ketoglutarat, koja je intermedijar ciklusa limunske kiseline. Transaminacija of α-ketoglutarata proizvodi glutamat. Rezultujući α-ketokiselinski produkt je takođe koristan, jer može biti korišćen bilo kao gorivo ili supstrat za dalje metaboličke procese. Na primer:
- Aspartat + α-ketoglutarat ⇌ oksaloacetat + glutamat
Piruvat i oksaloacetat su ključne komponente celularnog metabolizma, koje kontribuiraju kao supstrati ili intermedijeri u fundamentalnim procesima kao što su glikoliza, glukoneogeneza i isto tako Krebsov ciklus.
Glutamat igra važnu ulogu u odstranjivanju iz tela suvišnog ili beskorisnog azota. Glutamat podleže deaminaciji, jednoj oksidativnoj reakciji koju katališe glutamat dehidrogenaza, na sledeći način:
Amonijak (kao amonijum) se onda izlučuje prvenstveno kao ureja, sintetizovana u jetri. Transaminacija može tako biti povezana sa deaminacijom, efektivno dozvoljavajući azotu iz amin grupa amino kiselina da budu odstranjen, putem glutamata kao intermedijara, i konačno izlučen iz tela u obliku ureje.
Neurotransmiter
[уреди | уреди извор]Glutamat je najrasprostranjeniji uzbuđujući neurotransmiter u kičmenjačkom nervnom sistemu. U hemijskim sinapsama, glutamat se nalazi u mehurićima. Nervni impulsi izazivaju oslobađanje glutamata is pre-sinaptičkih ćelija. U naspramnim post-sinaptičkim ćelijama, glutamatni receptori, kao što je NMDA receptor, vezuju glutamat i aktiviraju se. Zbog njegove uloge u sinaptičkoj plastičnosti, glutamat je vezan za kognitivne funkcije kao što su učenje i memorija u mozgu[6]. Forma plastičnosti poznata kao dugotrajna potencijacija se dešava na glutamatergičkim sinapsama u hipokampusu, neokorteksu, i drugim delovima mozga. Glutamat ne funkcioniše samo kao tačka do tačke transmiter nego i putem prelivnog sinaptičkog preslušavanja između sinapsi u kome sumacija glutamata oslobođenog iz susednih sinapsi stvara ekstrasiptičku signalizaciju/prostornu transmisiju.[7]
Glutamatni transporteri[8] se nalaze u neuronima i glialnim membranama. Oni brzo odstranjuju glutamat iz ekstracelularnog prostora. Kod moždanih povreda ili bolesti, oni mogu da rade u reverzno, i višak glutamata se može akumulirati izvan ćelija. Taj proces uzrokuje da kalcijum joni prodiru u ćeliju putem kanala NMDA receptora, što dovodi do neuronkog oštećenja i eventualno do ćelijske smrti, to se zove ekscitotoksičnost. Mehanizam apoptoze uvrštava:
- Oštećenje mitohondrije zbog suviše visoke intracelularne Ca2+ koncentracije.[9]
- Glu/Ca2+-posredovana promocija transkripcionih faktora za proapoptotičke gene, ili potiskivanje transkripcionih faktora za antiapoptotičke gene.
Ekscitotoksičnost uzrokovana glutamatom se javlja kao deo ischemične kaskade, i asocirana je sa moždanim udarom, i bolestima kao što su amiotrofična lateralna skleroza, latirizam, autizam, neki oblici mentalne retardacije, i Alchajmerova bolest[10].
Glutaminska kiselina je bila povezana sa epileptičkim napadima. Mikroinjekcija glutaminske kiseline u neurone proizvodi niz spontanih depolarizacija sa razmakom od jedne sekunde, i taj patern paljenja je sličan onom koji je poznat kao paroksizmalno depolarizujuće pomeranje kod epileptičkog napada. Ta promena potencijala neaktivirane membrane u žiži epileptičkog napada može da prouzrokuje spontano otvaranje naponski-aktiviranog kalcijum kanala, što dovodi do oslobađanja glutaminske kiseline i dalje depolarizacije.
Eksperimentalne tehnike za detekciju glutamata u neoštećenim ćelijama uvrštavaju genetički-dizajniran nanosenzor.[11] Sensor je fuzija glutamat-vezujućeg proteina i dva fluorescentna proteina. Kad se glutamat veže, fluorescencija senzora pod ultraviolentnim svetlom se promeni putem rezonance između dva fluorofora. Uvođenje nanosenzora u ćelije omogućava optičku detekciju koncentracije glutamata. Sintetički analozi glutaminske kiseline koji se mogu aktivirati ultraviolentnim svetlom i dvo-fotonska ekscitaciona mikroskopija su isto bile opisane.[12] Metod brzog oslobađanja putem fotostimulacije je koristan za mapiranje konekcija između neurona, i razumevanje funkcija sinapse.
Evolucija glutamat receptora je potpuno različita kod bezkičmenjaka, posebno artropoda i nematoda, gde glutamat stimuliše glutamat-kontrolisane hlorid kanale. Beta podjedinice receptora su responsivne sa veoma visokim afinitetom na glutamat i glicin.[13] Modulacija tih receptora je bila terapeutski cilj antiparazitne terapije koristeći avermektine. Avermektinova meta je alfa-podjedinica glutamat-kontrolisanog hloridnog kanala.[14] Ti receptori su bili opisani kod artropoda, kao što je Drosophila melanogaster[15] i Lepeophtheirus salmonis.[16] Nepovratna aktivacija tih receptora sa avermektinom rezultuje u hiperpolarizaciji u sinapsama i neuromuskularnim sastavima, rezultujući u flacidnoj paralizi, i uginuću nematoda i artropoda.

Moždana non-sinaptička glutamatergična signalizaciona kola
[уреди | уреди извор]Ekstracelularni glutamat u mozgu Drozofile je bio nađen da reguliše grupisanje post-sinaptičkog glutamat receptora, kroz proces koji uvrstava desenzitizaciju receptora.[17] Geni izraženi u glijalnim ćelijama aktivno transportuju glutamat u ekstracelularni prostor,[17] dok kod nucleus accumbens usled stimulisanja grupe II metabotropiskog glutamat receptora, ti geni su nađeni da smanjuju nivoe ekstracelularnog glutamata.[18] To otvara mogućnost da taj ekstracelularni glutamat igra ulogu sličnu endokrinu kao deo većeg homeostatičnog sistema.
GABA prekurzor
[уреди | уреди извор]Glutamat isto služi kao prekurzor za sintezu inhibitornog GABA liganda u GABA-ergičnim neuronima. Ta reakcija je katalisana glutamat dekarboksilazom (GAD), koja je najzastupljenija u cerebelumu i u pankreasu.
Sindrom krute-osobe je neurološki poremećaj izazvan antiGAD antitelima, što dovodi do umanjenja GABA sinteze i otuda, umanjenih motornih funkcija kao što su muskularna krutost i spazam. Pošto je pankreas isto bogat ovim enzimom (GAD), direktna imunološka destrukcija se javlja u pankreasu i pacijenti obolevaju od dijabetisa.
Pojačivač ukusa
[уреди | уреди извор]Slobodna glutaminska kiseline je prisutna u širokom asortimanu hrane, uključujući sir i soja sos, i one je odgovorna za jedan od pet osnovnih ukusa ljudskog čula ukusa (umami). Glutaminska kiselina se često koristi kao prehrambeni aditiv i pojačivač ukusa u obliku njene natrijumove soli, mono-natrijum glutamata (MSG).
Hranljivi sastojak
[уреди | уреди извор]Sva mesa, živina, riba, jaja, mlečni proizvodi, kao i kombu su izvrsni izvori glutaminske kiseline. Neka protein-bogata biljna hrana isto služi kao izvor. Devedeset pet procenata mlečnog glutamata je metabolizovano u intestinalnim ćelijama u prvom prolazu.[19]
Uzgoj biljaka
[уреди | уреди извор]Auxigro je preparacija biljnog hormona rasta koja sadrži 30% glutaminske kiseline.
Proizvodnja
[уреди | уреди извор]Kineska Fufeng Grupa Limited je najveći proizvođač glutaminske kiseline na svetu, sa kapacitetom povećanim do preko 300,000 tona na kraju 2006 od 180,000 tona u toku 2006, čime oni pokrivaju 25%-30% Kineskog tržišta. Meihua drugi po veličini Kineski proizvođač.
Farmakologija
[уреди | уреди извор]Lek fenciklidin (bolje poznat kao PCP) non-kompetitivno antagonizira glutaminsku kiselinu na NMDA receptoru. Iz istog razloga, sub-anastetičke doze ketamina imaju jake disocijativne i halucinogene efekte. Glutamat ne prolazi lako kroz krvno moždanu barijeru, ali je umesto toga njegov transport posredovan transportnim sistemom visokog afiniteta.[20] On se može konvertovati u glutamin.
Vidi još
[уреди | уреди извор]Reference
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б David L. Nelson; Michael M. Cox (2005). Principles of Biochemistry (IV изд.). New York: W. H. Freeman. ISBN 0-7167-4339-6.
- ^ Renton, Alex (10. 7. 2005). „If MSG is so bad for you, why doesn't everyone in Asia have a headache?”. The Guardian. Приступљено 21. 11. 2008.
- ^ „Kikunae Ikeda Sodium Glutamate”. Japan Patent Office. 7. 10. 2002. Архивирано из оригинала 28. 10. 2007. г. Приступљено 21. 11. 2008.
- ^ McEntee, W. & Crook, T (1993). „Glutamate: its role in learning, memory, and the aging brain.”. Psychopharmacology. 111 (4): 391—401. PMID 7870979.
- ^ Okubo Y, Sekiya H, Namiki S, Sakamoto H, Iinuma S, Yamasaki M, Watanabe M, Hirose K, Iino M. (2010). Imaging extrasynaptic glutamate dynamics in the brain. Proc Natl Acad Sci U S A. 107: 6526—6531. PMID 20308566. doi:10.1073/pnas.0913154107. Недостаје или је празан параметар
|title=(помоћ) - ^ Shigeri Y, Seal RP, Shimamoto K (2004). „Molecular pharmacology of glutamate transporters, EAATs and VGLUTs”. Brain Res. Brain Res. Rev. 45 (3): 250—65. PMID 15210307. doi:10.1016/j.brainresrev.2004.04.004.
- ^ Manev H, Favaron M, Guidotti A, Costa E (1989). „Delayed increase of Ca2+ influx elicited by glutamate: role in neuronal death”. Mol. Pharmacol. 36 (1): 106—12. PMID 2568579.
- ^ Hynd MR, Scott HL, Dodd PR (2004). „Glutamate-mediated excitotoxicity and neurodegeneration in Alzheimer's disease.”. Neurochem Int. 45 (5): 583—95. PMID 15234100.
- ^ Okumoto, S.,; et al. (2005). „Detection of glutamate release from neurons by genetically encoded surface-displayed FRET nanosensors”. Proceedings of the National Academy of Sciences U.S.A. 102 (24): 8740—8745. PMC 15939876
 . PMID 15939876. doi:10.1073/pnas.0503274102.
. PMID 15939876. doi:10.1073/pnas.0503274102.
- ^ Ellis-Davies, G.C.R.,; et al. (2007). „4- Carboxymethoxy-5,7-dinitroindolinyl-Glu: an improved caged glutamate for expeditious ultra- violet and 2-photon photolysis in brain slices”. Journal of Neuroscience. 27 (Jun): 6601—6604. PMID 17581946. doi:10.1523/JNEUROSCI.1519-07.2007.
- ^ Laughton, D.L., Wheeler, S.V., Lunt, G.G. and Wolstenholme, A.J. 1995. "The beta-subunit of Caenorhabditis elegans avermectin receptor responds to glycine and is encoded by chromosome 1". J. Neurochem. 64, 2354-2357
- ^ Cully, D.F., Vassilatis, D.K., Liu, K.K., Paress, P.S., Van der Ploeg, L.H.T., Schaeffer, J.M. and Arena, J.P. 1994. "Cloning of an avermectin-sensitive glutamate gated choride channels from Caenorhabditis elegans". Nature 371, 707-711
- ^ Cully, D.F., Paress, P.S., Liu, K.K., Schaeffer, J.M. and Arena, J.P. 1996. "Identification of a Drosophila melanogaster glutamate-gated chloride channel sensitive to the antiparasitic agent avermectin". J. Biol. Chem. '271, 20187-20191'
- ^ Tribble, N.D., Burka, J.F. and Kibenge, F.S.B. 2007. "Identification of the genes encoding for putative gamma aminobutyric acid (GABA) and glutamate-gated chloride channel (GluCl) alpha receptor subunits in sea lice (Lepeophtheirus salmonis)". J. Vet. Pharmacol. Ther. 30, 163-167
- ^ а б Augustin H, Grosjean Y, Chen K, Sheng Q, Featherstone DE (2007). „Nonvesicular release of glutamate by glial xCT transporters suppresses glutamate receptor clustering in vivo”. Journal of Neuroscience. 27 (1): 111—123. PMC 2193629
 . PMID 17202478. doi:10.1523/JNEUROSCI.4770-06.2007.
. PMID 17202478. doi:10.1523/JNEUROSCI.4770-06.2007.
- ^ Xi, Zheng; Baker, DA; Shen, H.; Carson, DS; Kalivas, PW (2002). „Group II metabotropic glutamate receptors modulate extracellular glutamate in the nucleus accumbens”. Journal of Pharmacology and Experimental Therapeutics. 300 (1): 162—171. PMID 11752112. doi:10.1124/jpet.300.1.162.
- ^ Reeds, P.J.,; et al. (1. 4. 2000). „Intestinal glutamate metabolism”. Journal of Nutrition. 130 (4s): 978S—982S. PMID 10736365.
- ^ Smith, QR (2000). „Transport of glutamate and other amino acids at the blood-brain barrier”. J. Nutr. 130 (4S Suppl): 1016S—22S. PMID 10736373.
